bihar board class 10 chemistry notes chapter 1 | रासायनिक अभिक्रियाएँ एवं समीकरण
bihar board class 10 chemistry notes chapter 1 | रासायनिक अभिक्रियाएँ एवं समीकरण
अध्याय – 1
रासायनिक अभिक्रियाएँ एवं समीकरण
हमारे दैनिक जीवन में प्रत्येक क्षण कुछ-न-कुछ परिवर्तन होते रहते हैं। उदाहरण के लिए, दूध से दही बनना या दूध का फटना, चावल से भात का बनना, हमारे शरीर में भोजन का पचना आदि।
रासायनिक अभिक्रिया- ऐसे परिवर्तन जिसमें नए गुणों वाले पदार्थों का निर्माण होता है, उसे रासायनिक अभिक्रियाएँ कहते हैं।
उदाहरण– (i) भोजन का पाचन
(ii) श्वसन
(iii) लोहे पर जंग लगना, आदि।
इन कारकों से पता चलता है कि एक रासायनिक अभिक्रिया हुई हैं। जैसे, पदार्थ की स्थिति में परिवर्तन, पदार्थ का रंग बदलना, गर्मी का विकास, गैस का विकास, प्रकाश का विकास, आदि ।
bihar board class 10 chemistry notes chapter 1 | रासायनिक अभिक्रियाएँ एवं समीकरण
अभिकारक– ऐसे पदार्थ जो किसी रासायनिक अभिक्रिया में हिस्सा लेते है, उन्हें अभिकारक कहते हैं।
उत्त्पाद- ऐसे पदार्थ जिनका निर्माण रासायनिक अभिक्रिया में होता है, उन्हें उत्पाद कहते हैं।
उदाहरण–
मैग्नीशियम + ऑक्सीजन → मैग्नीशियम ऑक्साइड
(अभिकारक) (उत्पाद)
2 Mg + O2 → 2 Mgo
प्रतिफल– रासायनिक अभिक्रिया के फलस्वरूप बने नए पदार्थ को प्रतिफल कहते हैं।
H2+Cl2 → 2HCl
क्रियाकलाप– एक मैग्नीशियम रिबन लेकर असका दहन करने से पहले उसको रेगमाल से साफ किया जाता है, क्योंकि रेगमाल से मैग्नीशियम को साफ करने से उसके साथ जुड़ी हुई अशुद्धिया दूर हो जाती है और मैग्नीशियम ऑक्सीजन से आसानी से अभिक्रिया करता है और इसी तरहा O2 के साथ अभिक्रिया करके मेग्नीशियम ऑक्सइड़ बनता हैं।
रासायनिक समीकरण- दो या दो से अधिक अभिकारक मिलकर जब दो या दो से भी अधिक उत्पादों का निर्माण करते है, तो इस प्रकार से सम्पन्न होने वाले समीकरण ही रासयनिक समीकरण कहलाते हैं।
उदाहरण–
लेड नाइट्रेट + पोटेशियम आयोडाइट → लेड आयोडाइट + पौटेशियम नाइट्रेट
(अभिकारक) (उत्पाद)
Pb(NO3)2 + 2 KI → PbI2 + 2K NO3
(दायाँ भाग) (बायाँ भाग)
सन्तुलित रासायनिक समीकरण- ऐसी रासायनिक समीकरण जिसके दोनों पक्षों (बायीं तथा दायीं ओर) में प्रत्येक तत्व के परमाणुओं की संख्या बराबर होती है, वह सन्तुलित रासायनिक समीकरण कहलाती है।
- रासायनिक समीकरण को सन्तुलित करने की विधि को हिट एवं ट्रायल विधि कहते हैं।
उदाहरण– Fe + H₂O → Fe3O4 + H2
- निम्न अभिक्रिया में सबसे पहले उस तत्व को सन्तुलित करते है जिसकी मात्रा अभिकारक या उत्पाद में से सबसे ज्यादा होती हैं। जैसे यहा सबसे अधिक मात्रा उत्पाद ऑक्सीजन (0₄) की है, इसलिए सबसे पहले O2 को सन्तुलित करेंगे ।
Fe + 4 H2O → Fe3O4 + H2
- अब प्राप्त अभिक्रिया में अभिकारक हाइड्रोजन की मात्रा सर्वाधिक है इसलिए हाड्रोजन को सन्तुलित करेंगे। इसप्रकार उत्पाद हाइड्रोजन के आगे 4 लगऐंगे ।
Fe + 4 H₂O → Fe3O4 + 4H2
- अब प्राप्त अभिक्रिया में Fe (लोहे) की मात्रा संतुलित नहीं है इसलिए अभिकारक Fe के आगे 3 लगाएंगे।
3 Fe + 4H2O → Fe3O4 + 4H2
- इस प्रकार प्राप्त समीकरण सन्तुलित अभिक्तिया का समीकरण है।
द्रव्यमान संरक्षण का नियम- द्रव्यमान संरक्षण का नियम यह कहता है की, किसी भी रासायनिक अभिक्रिया में द्रव्यमान का न तो निर्माण होता है ना ही विनाश ।
- रासायनिक अभिक्रिया के पहले एवं उसके पश्चात प्रत्येक तत्व के परमाणुओं की संख्या समान होनी चाहिए।
रासायनिक अभिक्रियाओं के प्रकार-
1. संयोजन अभिक्रिया- ऐसी अभिक्रिया जिसमें दो या दों से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते है, उसे संयोजन अभिक्रिया कहते है।
उदाहरण-
CaO + H₂O → Ca(OH)2
कैल्सियम ऑक्साइड + जल → कैल्सियम हाइड्रोक्साइड
bihar board class 10 chemistry notes chapter 1 | रासायनिक अभिक्रियाएँ एवं समीकरण
ऊष्माक्षेची रासायनिक अभिक्रिया- जिन अभिक्रियाओं के उत्पाद के निर्माण के साथ ऊष्मा भी उत्पन्न होती हैं, उन्हें उष्माक्षेपी रासायनिक अभिक्रिया कहते हैं।
उदाहरण- (i) CH4(9) + O2(9) → C0₂(9) + 2H2O(9) + उष्मा
(प्राकृतिक गैस का दहन)
(ii) श्वसन एक उष्माक्षपी अभिक्रिया है।
(iii) शाक-सबजियों तथा वनस्पति द्रव का विघटन होकर कंपोस्ट होना भी उष्मादोपी अभिक्रिया हैं।
2. वियोजन (अपघटन) अभिक्रिया- कोई भी एकल अभिकर्मक टूट कर जब नये पदार्थ का निर्माण करते है तो इसे, वियोजन अभिक्रिया कहते हैं।
उदाहरण-

वियोजन अभिक्रियाएँ तीन प्रकार की होती हैं-
(i) ऊष्मीय वियोजन- ऐसी अभिक्रिया जिसमें पदार्थों का अपघटन होकर उत्पाद बनने में संपूर्ण अभिक्रिया ऊष्मा के द्वारा हो, उसे ऊष्मीय वियोजन या ऊष्मीय अपघटन अभिक्रिया कहते हैं।
उदाहरण-

- सिल्वर ब्रोमाइड का उपयोग श्याम श्वेत फोटोग्राफी में किया जाता हैं।
(ii) वैद्युत वियोजन- ऐसी अभिक्रिया जिसमें पदार्थों का वियोजन विदयुत धारा प्रवाहित करने पर होता हैं, उसे वैद्युत वियोजन कहते हैं।
bihar board class 10 chemistry notes chapter 1 | रासायनिक अभिक्रियाएँ एवं समीकरण
(iii) प्रकाशीय वियोजन- ऐसी अभिक्रिया जिसमें पदार्थों का वियोजन सूर्य के प्रकाश के उपस्थिती में होता हैं, उसें प्रकाशीय वियोजन कहते है।
उष्माशोषी अभिक्रिया- जिन अभिक्रियाओं में ऊर्जा अवशोषीत होती है, उन्हें उष्माशोषीत अभिक्रिया कहते हैं।
उदाहरण-

3. विस्थापन अभिक्रिया- ऐसी अभिक्रिया जिसमें अधिक क्रियाशील तत्त्व अपने से कम क्रियाशील तत्व को विस्थापित करता है और एक नये पदार्थ का निर्माण करता हैं।
उदाहरण-

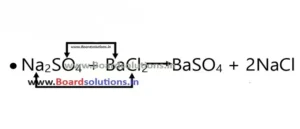
4. द्विविस्थापन अभिक्रिया- ऐसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक अपने आयनों का आदान प्रदान कर नये उत्पाद का निर्माण करते हैं।
उदाहरण-
5. उपचयन एवं अपचयन-
उपचयन- वह अभिक्रिया जिसमें ऑक्सीजन का योग होता है और हायड्रोजन का वियोग होता है।
अपचयन- अपचयन अभिक्रिया वह अभिक्रिया होती है जिसमें हाइड्रोजन का योग होता है और ऑक्सीजन का वियोग होता है।
| उपचयन अभिक्रिया
|
अपचयन अभिक्रिया
|
| उदाहरण-
2C4 + O2 → 2C4O +O2 -H2 |
उदाहरण- C4O + H2 → C4 + H2O + H2 – O2 |
रेडॉक्स अभिक्रिया- ऐसी अभिक्रिया जिसमें उपचयन और अपचयन अभिक्रिया एकसाथ हो, उसे रेडॉक्स अभिक्रिया कहते हैं।
उदाहरण- C40 + H₂ → Cu + H2O
bihar board class 10 chemistry notes chapter 1 pdf
bihar board class 10 chemistry chapter 1 solution
bihar board class 10 chemistry notes chapter 1 pdf download
bihar board class 10 chemistry notes chapter 1 solution download
Join our telegrame link for premium notes free
