bihar board class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण
bihar board class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण
अध्याय – 2
अम्ल, क्षारक एवं लवण
अम्ल– वह पदार्थ जिसका स्वाद खट्टा होता है तथा जो निले लिटमस पेपर (Litmus Paper) को लाल कर देता है, अम्ल कहलाता हैं।
उदाहरण– HCl, H2SO4, CH₃COOH आदि।
भस्म– भस्म वह पदार्थ है जिसका जलीय विलयन स्वाद में कड़वा होता है तथा अम्ल को उदासीन कर लवण बनाता है।
आर्हेनियस द्वारा अम्ल की परिभाषा– अम्ल वह पदार्थ है जो जल में घुलकर हाइड्रोजन आयन देता है।
आर्हेनियस द्वारा भस्म की परिभाषा– भस्म वह पदार्थ है जो जल में घुलकर हाइड्रॉक्साइड आयन देता है।
अम्ल के भौतिक एवं रासायनिक गुणों को लिखें।
उत्तर- अम्ल के भौतिक एवं रासायनिक गुण निम्नलिखित हैं-
(i)अम्ल स्वाद में खट्टे होते हैं।
(ii) जलीय विलयन में H+ आयन देते हैं।
(iii) अम्ल जल में हायड्रोनियम आयन (H3O+) का निर्माण करते हैं।
(iv) अम्ल धातु कार्बोनिट या हाइड्रोजन कार्बोनेट के साथ अभिक्रिया कर CO₂ निष्कासित करते हैं।
(vi) अम्ल धातुओं से क्रिया करके लवण (salt) और जल बनाता हैं।
(vii) अम्ल जलीय विलयन में विद्युतधारा प्रवाहित करतें हैं।
अम्लों के प्रकार-
- प्रबल अम्ल- ऐसे अम्ल जो जलीय विलयन में पूर्णतः आयनित हो जाते है, वह प्रबल अम्ल कहलाते हैं। प्रबल आयनों में प्रोटॉन अर्थात हाइड्रोजन आयन (H+) त्याग करने की उच्च क्षमता होती हैं।
उदाहरण – (i) H₂604 (सल्फ्यूरिक अम्ल)
(ii) Hcl (हाइड्रोक्लोरिक अम्ल)
(iii) HNO3 (नाइट्रिक अम्ल) आदि ।
- दुर्बल अम्ल- ऐसे अम्ल जो जलीय विलयन में पूर्णतः आयनित न हो कर आंशिक रूप से आयनित होते हैं, उन्हें दुर्बल अम्ल कहते हैं।
उदाहरण– (i)CH₃COOH (एसिटिक अम्ला
(ii) HCOOH (फॉर्मिक अम्ल)
(iii) H₂S (हाइड्रोजन सल्फाइड)
- सान्द्र अम्ल- ऐसे अम्ल जिन्में अम्ल अधिक मात्रा मे होता है, जबकि जल अल्प मात्ता में होता है वह सान्द्र आम्ल होते हैं।
- तनु अम्ल- ऐसे अम्ल जिनमें अम्ल अल्प मात्रा में होता है, जबकि जल अधिक मात्रा में होता है, वह तनु अम्ल होते हैं।
दैनिक जीवन में चभ् का महत्व-
- पेट की अम्लीयता (एसिडिटी) व गैस की समस्या को दूर करने के लिए क्षारीय प्रकृति वाले मिल्क ऑफ मैग्नीशिया का प्रयोग किया जाता है।
- अम्लीय वर्षा में जल का pH मान 5.6 से कम होता है। इस जल के फलस्वरुप नदियों का pH मान भी कम हो जाता है जो कि जलीय जीवों पर हानिकारक प्रभाव डालता है।
- दांत का इनामेल कैल्शियम सल्फेट का बना होता है। दांतों की सफाई नहीं करने पर बैक्टीरिया के सड़ने से अम्लों की उत्पत्ति होती है जिनसे मुंह की लार का पीएच 5.5 से कम चला जाता है और इनामेल को नुकसान पहुंचाता है। इसके उपाय हेतु टूथपेस्ट में क्षारीय पदार्थ प्रयुक्त किए जाते हैं।
- मधुमक्खी के डंक में मेथेनॉइक अम्ल होता है। इसके डंक से होने वाली जलन को शांत करने के लिए क्षारीय प्रकृति के बेकिंग सोडा का प्रयोग किया जाता है।
- उपजाऊ मिट्टी का पीएच मान भी एक निश्चित परास में होता है।
- अम्ल एवं क्षारक की अभिक्रिया वेफ परिणामस्वरूप लवण तथा जल प्राप्त होते हैं तथा इसे उदासीनीकरण अभिक्रिया कहते हैं। सामान्यतः उदासीनीकरण अभिक्रिया को इस प्रकार लिख सकते हैं।
क्षारक + अम्ल →लवण+जल
bihar board class 10 chemistry notes chapter 2 | अम्ल, क्षारक एवं लवण
क्षारक- ऐसे पदार्थ जो स्वाद में कड़वे होते है और क्षारीय विलयन में लाल लिटमस पत्र को नीला कर देते हैं।
उदाहरण- NaOH, Mg(OH)2 आदि।
अम्ल क्षारक एवं लवण
क्षारक के भौतिक एवं रासायनिक गुणों को लिखें|
उत्तर- क्षारक के भौतिक एवं रासायनिक गुण निम्नलिखित हैं-
(i) क्षारक स्वाद में कड़वे होते हैं।
(ii) जलीय विलयन में OH– आयन देते हैं।
(iii) क्षार धातु के साथ अभिक्रिया कर H₂ मुक्त करते हैं।
(iv) क्षार अम्लीय ऑक्साइड के साथ अभिक्रिया कर लवण बनाते हैं।
सूचक- सूचक किसी दिए गए विलयन में अम्ल या क्षारक की उपस्थिति दर्शाते हैं। इनका रंग या गंध अम्लीय या क्षारक माध्यम में बदल जाता हैं।
सूचक के प्रकार–
- प्राकृतिक सूचक– ऐसे सूचक जो प्राकृतिक स्रोतों से प्राप्त होते है, वह प्राकृतिक सूचक कहलाते हैं।
उदाहरण- लिटमस पत्र, हल्दी आदि।
लिटमस अम्ल- अम्ल तथा क्षारक की पहचान के लिए सबसे सामान्य रूप से उपयोग में लाया जाने वाला प्राकृतिक सूचक लिटमस हैं।
लिटमस विलयन के रूप में तथा कागज की पट्टियों के रूप में उपलब्ध होता हैं।
हल्दी– हल्दी भी एक अन्य प्रकार का प्रकृतिक सूचक हैं।
2. संश्लेषित सूचक- यह वे सूचक है जो प्राकृतिक नहीं होते परंतु ये रासायनिक पदार्थों द्वारा बनाए गए होते हैं।
उदाहरण- मेथिल ऑरेंज एवं फिनोल्फ्थेलीन।
3. गंधीय सूचक– कुछ ऐसे पदार्थ होते हैं जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है, ऐसे पदार्थों को गंधीय सूचक कहते हैं।
4. सार्वत्रिक सूचक- सार्वत्रिक सूचक विभिन्न रसायनों का बना हुआ वह मिश्रण होता है जो भिन्न-भिन्न PH वाले पदाथों के बारें में रंग परिवर्तन के द्वारा बता देता है कि वह क्षारक है या अम्ल।
लवण- जब अम्ल और क्षार एक दूसरे से अभिक्रिया करते है तब एक यौगिक बनता है, जिसे लवण कहते हैं।
HCl+NaOH→NaCl+H2O
![]()
सोडियम हाइड्रॉक्साइड के उपयोग-
- साबुन तथा अपमार्जक बनाने में
- कागज बनाने में
- प्रयोगशाला में अभिकर्मक के रूप में
हाइड्रोजन गैस का उपयोग–
- वनस्पति तेल का हाइड्रोजनीकरण कर उन्हें वनस्पती घी में परिणत करने में
- हैबर विधि द्वारा अमोनिया बनाने में
क्लोरीन गैस का उपयोग–
- कपड़ों एवं कागज को विरंजित करने में
- कीटाणुनाशक होने के कारण पेयजल को शुद्ध करने में
- विरंजक चूर्ण बनाने में सोडियम बाइकार्बोनेट या सोडियम होइड्रोजनकार्बोनेट (खाने का सोडा, NaHCO3) सोडियम बाइकार्बोनेट को अमोनिया-सोडा विधि या साल्वे विधि द्वारा तैयार किया जाता है।
लवण के भौतिक एवं रासायनिक गुणों को लिखें।
उत्तर- लवण के भौतिक एवं रासायनिक गुण निम्नलिखित हैं-
(i) लवण ठोस अवस्था में मिलते हैं।
(ii) सामान्यतः लवण उदासीन होते हैं।
(iii) लवणों के जलीय विलयन विद्युत के सुचालक होते हैं।
उदाहरण- NaCl, CaSO4 आदि।
लवणों को मुख्यतः 6 भागों में बाटा गया है-
- सामान्य लवण- NaCl, KCl, K2SO4 आदि ।
- अम्लीय लवण- NaSO4, NaHCO3, KHCO3
- क्षारीय लवण- Mg(OH)Cl, C4(OH)Cl
- द्विक लवण- K2SO4. Al2(SO4)3, 24H₂O (फिटकरी)
- संकर लवण- K4[Fe(CN)6] (पोटैशियम पेरस सायनाइड), Na (Ag (CN)2] (सोडियम सिल्वर सायनाइड)
- मिश्चीत लवण- NaKSo4, Ca (OCl)Cl, MgNH4PO4
PH- हाइड्रोजन की क्षमता
PH मान– किसी भी विलयन का PH मान यह बताता है की वह विलयन क्षारीय है अथवा अम्लीय । किसी विलयन का PH मान उसमे उपस्थित (H+) आयन पर निर्भर करता है, इसी लिए इसे PH यानी – हाइड्रोजन की क्षमता (Potential of Hydrogen) कहते है।
![]()
class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण pdf solutions notes
PH पैमान– PH मान मापने के लिए PH पैमान का उपयोग किया जाता है, इससे किसी भी विलयन की अम्लीयता एवं क्षारकता मापी जाती हैं।
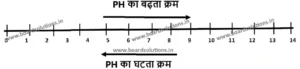
(i) PH पैमान का अविष्कार सरेंसन ने किया था।
(ii) PH पैमान (PH scale) में 0 से लेकर 14 तक बिंदू होते हैं।
(iii) यदि किसी विलयन का PH मान 7 हो, तो वह उदासीन होता हैं।
(iv) अगर किसी विलयन का PH मान 7 से कम है, तो उसकी प्रकृति अम्लीय होगी।
(v) यदि किसी विलयन का PH मान 7 से अधिक हो, तो उसकी प्रकृति क्षारीय होती हैं।
सोडा विधि या साल्वे विधि सिद्धांत– अमोनिया गैस से संतृप्त सोडियम क्लोराइड के संतृप्त जलीय विलयन में कार्बन डाइऑक्साइड गैस प्रवाहित करने के फलस्वरूप सोडियम बाइकार्बोनेट प्राप्त होता है।
NaCl + H2O + CO2 + NH3 → NH4Cl + NaHCO3
गुण- सोडियम बाइकार्बोनेट का जलीय विलयन क्षारीय होता है तथा इस विलयन का pH मान 7 से अधिक होता है। 2. NaHCO3 अम्लों को उदासीन करता है तथा अभिक्रिया के फलस्वरूप CO2 गैस निकलती है।
NaHCO3 + HCl → NaCl + CO2↑+ H2O
सोडियम बाइकार्बोनेट का उपयोग–
- इसका उपयोग बेकिंग पाउडर बनाने में किया जाता है।
- पेट की अम्लीयता कम करने के लिए औषधि (ऐंटासिड) के रूप में प्रयोग किया जाता है।
- इसका उपयोग अग्निशामक यंत्रों में भी किया जाता है।
- रसोईघर में, खाने के सोडा का उपयोग खस्ता व्यंजन बनाने के लिए किया जाता है। कभी-कभी इसका इस्तेमाल खाना जल्द पकाने के लिए भी किया जाता है। सोडियम कार्बोनेट या धोने का सोडा(Na2CO3 . 10H2O) सोडियम कार्बोनेट या धोने का सोडा प्रायः अमोनिया-सोडा विधिया साल्वे विधि से तैयार किया जाता है। अमोनिया सोडा विधि या साल्वे विधि सिद्धांत- अमोनिया गैस से संतृप्त सोडियम क्लोराइड के संतृप्त जलीय विलयन में कार्बन डाइऑक्साइड गैस प्रवाहित करने पर सोडियम बाइकार्बोनेट प्राप्त होता है।
NaCl + H2O + CO2 + NH3 → NH4Cl + NaHCO3
सोडियम बाइकार्बोनेट को गर्म करके सोडियम कार्बोनेट प्राप्त किया जाता है।
2NaHCO3→Na2CO3 + CO2 + H2O
सोडियम कार्बोनेट के रवाकरण से धोने का सोडा (Na2CO3, 10H2O) प्राप्त होता है।
गुण- Na2CO3 का जलीय विलयन क्षारीय होता है। Na2CO3 अम्लों को उदासीन बनाता है। सोडियम कार्बोनेट के विलयन में CO2 गैस प्रवाहित करने पर सोडियम बाइकार्बोनेट बनता है।
Na2CO3 + CO2 + H2O →2NaHCO3
धोने के सोडा का उपयोग–
- कपड़ा आदि धोने में इसका उपयोग होता है।
- यह प्रयोगशाला में अभिकर्मक के रूप में व्यवहार किया जाता है।
- काँच, कागज, साबुन आदि के उत्पादन में इसका उपयोग किया जाता है।
- जल का स्थायी खारापन दूर करने में का उपयोग होता है।
विरंजक चूर्ण– जब चूने के पानी में क्लोरीन गैस प्रवाहीत की जाती है तो विरंजक -चूर्ण का निर्माण होता हैं। इसका रासायनिक सूत्र C9OCl₂ हैं। इसका रासायनिक नाम – कैल्सियम क्लोरो ऑक्साइड हैं।
Ca(OH)2 + Cl₂ → CaCl2 + H₂O
Note- किसी पदार्थ का रंग उड़ाने की प्रक्रिया को विरंजन कहते हैं तथा जिस पदार्थ की सहायता से विरंजन होता है, उसे विरंजक कहते हैं।
विरंजक चूर्ण के उपयोग –
(i) क्लोफार्म ((HCl3) बनाने में।
(ii) चीनी का रंग सफेद करने में।
(iii) विरंजक के रूप में।
(iv) जल को शुद्ध करने में।
Note- बेकिंग सोडा- NaHCO3 (सोडियम बाइ कार्बोनेट)
रासायनिक अभिक्रिया –
NaCl + H2O + CO2 + NH₃ → NH4Cl + NaHCO3
बेकिंग सोडे का उष्मीय अपघटन-
![]()
class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण solutions
class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण pdf solutions
class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण in pdf download
class 10 chemistry notes chapter 2 | अम्ल क्षारक एवं लवण pdf solutions
Bihar board class 10th solutions
Join our telegrame link for premium notes free
