bihar board class 9th chemistry ch 3 notes in hindi | परमाणु एवं अणु
bihar board class 9th chemistry ch 3 notes in hindi | परमाणु एवं अणु
अध्याय 3- परमाणु एवं अणु
रासायनिक संयोजन के नियम–
किन्हीं दो या उससे अधिक पदार्थों के बीच रासायनिक अभिक्रिया कुछ सिद्धान्तों पर आधारित होती है। इन सिद्धान्तों को रासायनिक संयोजन के नियम कहते हैं।
रासायनिक संयोजन के नियम-
(i) द्रव्यमान संरक्षण का नियम
(ii) स्थिर अनुपात का नियम
(iii) गुणति अनुपात का नियम- इनका अध्ययन उच्च कक्षाओ में किया जाएगा
(iv) पारस्परिक अनुपात का नियम- इनका अध्ययन उच्च कक्षाओ में किया जाएगा
(v) गै-लुसैक का गैसीय आयतनों का नियम- इनका अध्ययन उच्च कक्षाओ में किया जाएगा
द्रव्यमान संरक्षण का नियम-
(i) इस नियम के अनुसार, “द्रव्यमान का उदय या विनाश संभन नहीं है।”
(ii) किसी रासायनिक अभिक्रिया के लिए इस नियम का उपयोग निम्नलिखित तरीके रो किया जा सकता है।
(iii) किसी भी रासायनिक अभिक्रिया के दौरान पदार्थों के द्रव्यमान का जोड उस अभि क्रिया के उत्पादों के द्रव्यमानों के जोड के बराबर होगा।”
उदाहरण-


bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु pdf download
प्रश्न- एक अभिक्रिया में 5.3g सोडियम कार्बोनेट एवं 6.0g एथेनाइक अम्ल अभिक्रित होते हैं। 2.2g कार्बन डाई ऑक्साइड, 8.2g सोडियम एथेनोएट एवं 0.9g जल उत्त्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण दव्यमान संरक्षण के नियम को सिद्ध करता है।
सोडियम कार्बोनेट + एथेनोइक अम्ल → सोडियम एथेनोएट + कार्बन-डाई-ऑक्साइड + जल
उत्तर-
सोडियम कार्बोनेट + एथेनोइक अम्ल → सोडियम एथेनोएट + कार्बन-डाई-ऑक्साइड + जल
(पदार्थ) (उत्पाद)
द्रव्यमान, संरक्षण के नियमानुसार-
सोडियम कार्बोनेट का द्रव्यमान + ऐथेनाइक अम्ल द्रव्यमान + सोडियम ऐथेनोएट का द्रव्यमान + कार्बन-डाई-ऑक्साइड का द्रव्यमान + जल का द्रव्यमान
द्रव्यमानों को समीकरण में प्रस्तुत करने के उपरान्त–
5.3g + 6.0g = 8.2g + 2.2g + 0.9g
11.3g = 11.3g
क्योंकि LHS = RHS
अत:, यह उत्तर द्रव्यमान संरक्षण के नियम को स्पष्ट करता है।
स्थिर अनुपात का नियम– इस नियमानुसार कोई शुद्ध रासायनिक यौगिक सदैव उन्हीं तत्वों से निर्मित होगा जिनसे वह मिलकर निर्मित हुआ है, तथा इन तत्वों के द्रव्यमान का अनुपात सदैव समान होगा, फिर चाहे यह यौगिक किसी भी स्थान से प्राप्त किया गया हो अथवा निर्माण किसी भी पद्धति द्वारा किया गया हो।
उदाहरण-
18g H₂O = 16g ऑक्सीजन + 2g हाइड्रोजन, या mH /m0 = 2/1 = 1/8
36g H2O = 32g ऑक्सीजन + 4g हाइड्रोजन, या mH /m0 = 4/32 = 1/8
09g H₂O = 08g ऑक्सीजन + 01g हाइड्रोजन, या mH /m0 = 1/8
ऊपर प्रस्तुत उदाहरण में H₂O के अलग अलग द्रव्यमानों वाले H₂O के नमूनों को लिया गया, पर उन सबमें हाइड्रोजन तथा ऑक्सीजन के द्रव्यमानों का अनुपात सदा 1:8 ही निकला।
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु free pdf download
प्रश्न- यदि हाइड्रोजन तथा ऑक्सीजन 1:8 के द्रव्यमान अनुपातानुसार अभिक्रित होकर जल का संचयन करते हैं। यदि जहाँ 3g हाइड्रोजन गैस ली गई हो तब ऑक्सीजन का कितना द्रव्यमान इस हाइड्रोजन गैस से अभिक्रत हो जल का संचयन करेगा ?
उत्तर-

या, 24g ऑक्सीजन गैस, 3g हाइड्रोजन गैस के अभिक्रित हो 27gm जल का संचयन करेगी।
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु pdf
डाल्टन का परमाणु सिद्धान्त- रासायनिक संयोजन के नियम पर आधारित डॉल्टन के परमाणु सिद्धान्त, ‘द्रव्यमान संरक्षण का नियम’ तथा ‘स्थिर अनुपात के नियम’ को सिद्ध करता है।
डॉल्टन के परमाणु सिद्धान्त के महत्वपूर्ण अंश-
(i) सभी द्रव्य परमाणुओं से निर्मित होते हैं।
(ii) परमाणु आविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो उत्पन्न होते हैं न ही उनका इसमें विनाश होता है। (यह अंश द्रव्यमान संरक्षण के नियम को सिद्ध करता है)
(iii) दिए गए तत्व के सभी परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
(iv) भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म भिन्न-भिन्न होते हैं।
(v) भिन्न-भिन्न तत्वों परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक का निर्माण करते हैं। (यह अंश स्थिर अनुपात के नियम को सिद्ध करता है)
(vi) किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एक प्रकार निश्चित होती हैं।
परमाणु(Atom)- आधुनिक परमाणु सिद्धान्त के अनुसार “परमाणु किसी भी तत्व का वह सूक्ष्मतम भाग है जो किसी रासायनिक अभिक्रिया में बिना अपने रासायनिक एवं भौतिक गुणधर्मों को बदले, उस अभिक्रिया में प्रयुक्त होता है।”
Note-(i) परमाणु तत्व के सूक्ष्मतम भाग है जिन्हें किसी भी शक्तिशाली सूक्ष्मदर्शी से भी देखा नहीं जा सकता।
Note-(ii) सबसे सूक्ष्म हाइड्रोजन परमाणु की परमाणु त्रिज्य 0.37 × 10 10 m या 0.037 min होती है।
जहाँ, 1nm = 10-10 m
IUPAC (International Union of Pure and Applied Chemistry) द्वारा स्वीकृत तत्वों के चिह्न-
| तत्व | चिह्न | तत्व | चिह्न | तत्व | चिह्न |
| Aluminium | Al | Copper | Cu | Nitrogen | N |
| Argon | Ar | Fluorine | F | Oxygen | O |
| Barium | Ba | Gold | Au | Potassium | K |
| Calcium | Ca | Hydrogen | H | Silicon | Si |
| Chlorine | Cl | Iodine | I | Silver | Ag |
| Cobalt | Co | Iron | Fe | Sodium | Na |
| lead | Pb | Sulphur | S | Zinc | Zn |
किसी भी तत्व के एक परमाणु का द्रव्यमान, उसका “परमाणु द्रव्यगान” कहलाता है। 1961 वर्ष में IUPAC ने “परमाणु द्रव्यमान की इकाई” या “u” को परमाणुओं के द्रव्यमान का मापक माना।
परमाणु द्रव्यमान की इकाई- एक परमाणु द्रव्यमान की इकाई का द्रव्यमान एक C12 समस्थानिक के 1/12 वें हिस्से के द्रव्यमान के बराबर होता है।
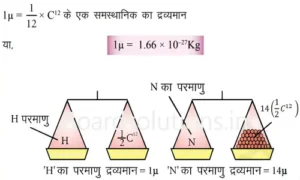
इसी तरह से-
|
तत्व |
परमाणु द्रव्यमान |
| (i) Hydrogen
(ii) Carbon (iii) Nitrogen (iv) Oxygen (v) Sodium (vi) Magnisium (vii) Sulphur (viii) Chlorine (ix) Calcium |
1μ
12μ 14μ 16 μ 23μ 24μ 32μ 35.5μ 40μ |
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु solution pdf
परमाणु किस प्रकार अस्तित्व में रहते हैं-
(i) ज्यादातर तत्वों के परमाणु अत्यधिक अभिक्रियाशील होने के कारण कभी भी मुक्तावस्था में नहीं पाए जाते।
(ii) केवल निष्क्रीय गैसों के परमाणु ही मुक्तावस्था में पाए जाते हैं।
उदाहरण: He, Ne, Ar, Kr, Xe, Rn
निष्क्रिय गैसों के परमाणुओं को छोड़ अन्य ज्यादातर तत्वों के परमाणु या तो अणुओं का निर्माण करते हैं या फिर आयन के रूप में पाए जाते हैं।
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु pdf solution download
अणु (Molecules):
(i) किसी अणु का निर्माण दो या उससे अधिक परमाणुओं के बीच रासायनिक बंध उत्पन्न होने के कारण होता है।
(ii) अणु, तत्वों को छोड़ किसी भी पदार्थ की वह सूक्ष्मतम इकाई है। जो स्वतंत्र रूप से रह सकता है और यह उस पदार्थ के सारे गुणधर्मों को प्रदर्शित कर सकता है।
जैसे की, H₂O अणु जल की सम्पूर्ण गुणधर्मों को प्रदर्शित कर सकता है।
(iii) किसी भी अणु का निर्माण एक ही तरह के परमाणु या भिन्न-भिन्न प्रकार के परमाणुओं के बीच रासायनिक बंध होने के कारणवश हो सकता है।
इसी आधार पर अणुओं को दो भागों के बाँटा जा सकता है:-
1. एक तरह के परमाणुओं से निर्मित
उदाहरण- O2 , N2 , O2 , S8 , P4 etc.
2. भिन्न तरह के परमाणुओं से निर्मित (इन्हें यौगिक भी कहा जाता है)
उदाहरण- H₂O, CO2, NaCl, CaCO3 , etc.
परमाणुकता- किसी एक अणु में उपस्थित परमाणुओं की संख्या को परमाणुकता कहते हैं।
| क्र.स. | तत्व | परमाणुकता |
| 1.
2. 3. 4. 5. 6. |
Argon
Helium Oxygen Hydrogen Phosphorus Sulphur |
एक परमाणुक
एक परमाणुक द्वि-परमाणुक द्वि-परमाणुक चतुर्यपरमाणुक बहुपरमाणुक |
Note- निष्क्रीय गैसें एक परमाणुक अणुओं का निर्माण करती हैं।
रासायनिक सूत्र- किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है।
रासायनिक सूत्र की विशेषताएँ-
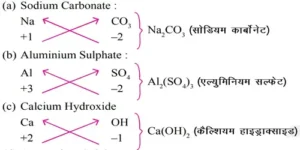
(i) रासायनिक सूत्र के संघटकों की संयोजकताएँ या आवेश बराबर होने चाहिए।
(ii) धातु एवं अधातु के यौगिक की रासायनिक सूत्र की संरचना में धातु को पहले लिखा जाता है तथा अधातु को उसके बाद।
उदाहरण – CaO, NaCl, CuO.
(iii) बहुपरमाणविक आयन के रासायनिक सूत्र में आने की स्थिति में, इस आयन को ब्रेकिट में रखा जाता है। फिर संयोजक अथवा आवेश को ब्रेकिट के नीचे लगाते हैं।
उदाहरण– Ca(OH)2 , (NH4)2 , SO4
आणविक द्रव्यमान- किसी भी एक अणु के उपस्थित परमाणुओं के द्रव्यमानों के जोड़ को आणविक द्रव्यमान कहा जाता है। परमाणु द्रव्यमान की भाँति इसका मात्रक भी परमाणु की द्रव्यमान इकाई ही होता है।
उदाहरण –
H2O का द्रव्यमान = 2 x 4 का द्रव्यमान + 1 x 0 का द्रव्यमान
H₂O का द्रव्यमान = (2 x 1) + (1 x 16) = 18μ
सूत्र इकाई द्रव्यमान– किसी पदार्थ का सूत्र इकाई द्रव्यमान उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है।
सूत्र द्रव्यमान एवं आणविक द्रव्यमान में केवल अंतर यही है कि यहाँ पर हम उस पदार्थ के सूत्र इकाई द्रव्यमान का उपयोग करते हैं, जिसके संघटक आयन होते हैं।
उदाहरण-
NaCl का द्रव्यमान = 1 x Na+ का द्रव्यमान + 1 x Cl का द्रव्यमान
= 1 x 23 + 1 × 35.5
NaCl का द्रव्यमान = 58.5µ
रासायनिक सूत्र लिखने के नियम-
(i) सबसे पहले तत्वों के परमाणुओं के चिह्नों को लिखा जाता है।
(ii) अब इन चिह्नों के नीचे इनकी संयोजकताओं को लिखा जाता है।
(iii) अब संयोजित परमाणुओं की संयोजकताओं को क्रास करते हैं।
(iv) परिणामस्वरूप पहला परमाणु दूसरे परमाणु की संयोजकता ग्रहण करता है तथा दूसरा परमाणु पहले वाले परमाणु की संयोजकता के ग्रहण करता है।
(v) संयोजकताओं को क्रास करके रासायनिक सूत्र तैयार हो जाता है।



bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु pdf
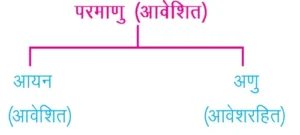
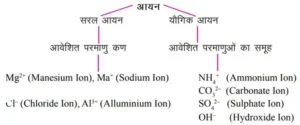
आयन(Ion)- आयन, एक परमाणु या परमाणुओं का रामूह होता है जिरा पर कुछ आवेश (धनात्मक या ऋणात्मक) अवश्य उपस्थित रहता है।
धनावेशित आयन– Na+, K+, Ca2+, Al3+
ऋणावेशित आयन– CP–, S²–, OH–, SO42-
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु
आयनिक यौगिकों के रासायनिक सूत्र (यौगिक आयन)–
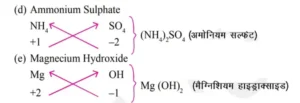
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु pdf note
गोलर द्रव्यमान- मोलर द्रव्यमान किसी भी पदार्थ के एक मोल कणों के द्रव्यमानों का जोड़ होता है।
यानि, मोलर द्रव्यमान एक मोल पदार्थ कणों का द्रव्यमान
या, मोलर द्रव्यमान = 6.022 x 1023 पदार्थ कणों का द्रव्यमान
उदाहरण- (a) Hydrogen का परमाणु द्रव्यमान ‘1μ’ है जबकि इसका मोलर द्रव्यमान 1gm/mol होता है।
(b) Nitrogen का परमाणु द्रव्यमान ’14μ ‘ है, जबकि इसका मोलर द्रव्यमान 14g/ mol होता है।
(c) S8 का मोलर द्रव्यमान = 8 ‘S’ का द्रव्यमान = 8 × 32 = 256gm
(d) HCl का मोलर द्रव्यमान = H का मोलर द्रव्यमान + Cl का मोलर द्रव्यमान
= 1 + 35.5 = 36.5gm/mol.
मोल-संकल्पना- मोल, 6.022 × 1023 कणों (परमाणु, अणु या आयन) का समूह है।
1 मोल परमाणु = 6.022 × 1023 परमाणु
1 मोल अणु = 6.022 × 1023 अणु
उदाहरण–
1 मोल Oxygen = 6.022 × 1023 Oxygen परमाणु
6.022 × 1023 को आवागाद्रो संख्या कहा जाता है।
Note- 1 मोल परमाणुओं का द्रव्यमान उनके ग्राम में तोलित परमाणु द्रव्यमान के बराबर होगा।
महत्वपूर्ण सूत्र(Important Formula)-

प्रश्न- 2.2gm लोहे के हिस्से में उपस्थित लोहे के परमाणुओं की संख्या ज्ञात करें ? (लोहे का परमाणु द्रव्यमान = 564)
उत्तर-
1 मोल लोहा (Fe) = 56gm (ग्राम में प्रयुक्त परमाणु द्रव्यमान)
या, 1 मोल लोहा (Fe) = 6.022 x 1023 लोहे के परमाणु
या, 56gm लोहा (Fe) = 6.022 x 1023 लोहे के परमाणु
![]()
प्रश्न-यदि किसी पदार्थ के एक अणु का द्रव्यमान 5.32 × 10-23gm है। इस पदार्थ का मोलर द्रव्यमान ज्ञात करें।
उत्तर-
पदार्थ के एक अणु का द्रव्यमान = 5.32 × 10–23gm
अत:, 6.022 × 10-23gm अणुओं का द्रव्यमान = 5.32 × 10–23gm x 6.022 × 10-23gm
प्रश्न- 0.5 गोल ‘N.’ गैस का द्रव्यमान ज्ञात करें।
उत्तर-
1 मोल N2 गैस = ग्राम में प्रयुक्त ‘N2 ‘ का मोलर द्रव्यमान
या, 1 मोल N2 गैस = 28 ग्राम
अत:, 0.5 मोल ‘ N2 ‘ गैस = 0.5× 28 = 14gm ‘N2‘
प्रश्न- 8gm ‘O2‘ अणुओं में इनकी संख्या ज्ञात करें।
उत्तर-
ग्राम में प्रयुक्त ‘ O2‘ का मोलर द्रव्यमान = 6.022 × 1023 ‘ O2‘ अणु
या, 32gm ‘ O2‘ अणु = 6.022 x 1023 ‘ O2‘ अणु
या, 8gm ‘ O2‘ अणु = 6.022 x 1023 x 8/32 ‘ O2‘ अणु।
अत:, 8gm ‘O2‘ अणु = 1.51 × 1023 ‘ O2‘ अणु
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु pdf
bihar board class 9th chemistry ch 3 notes in hindi परमाणु एवं अणु free pdf download
परमाणु एवं अणु Class 9 Notes
Join our telegrame link for premium notes free
